Ein heilendes Polymerband
Freiburg, 26.07.2013
Gele aus Algen lassen Blutgefäße wachsen: Prof. Dr. Prasad Shastri vom Institut für Makromolekulare Chemie und dem Exzellenzcluster BIOSS Centre for Biological Signalling Studies, Aurelien Forget und Jon Christensen von BIOSS und Dr. Steffen Lüdeke vom Institut für Pharmazeutische Wissenschaften haben ein neuartiges Gel entwickelt, das die Regeneration und das Wachstum menschlichen Gewebes fördert. Das Gel leitet sich von Agarose ab, einem Zuckerpolymer, das aus Algen gewonnen wird. Es kann als Gerüst für Zellen dienen, damit sie sich zu einem Gewebe verbinden. Im Artikel, Titel der aktuellen Ausgabe der Fachzeitschrift „Proceedings of the National Academy of Sciences“, zeigen Shastri und seine Kollegen, wie dank dieses so genannten Hydrogels der Aufbau von Blutgefäßen aus einzelnen Zellen gelang. In der Medizin können diese Gele helfen, das Heilen von Schäden an verschiedensten Geweben zu verbessern.
Die Organisation von Zellen als Gewebe wird durch eine spezielle extrazelluläre Umgebung beeinflusst. Diese Umgebung besteht aus großen Molekülen wie Kollagen und Zuckerpolymeren. Mechanische Signale, die durch diese Matrix vermittelt werden, sind wichtig für das Überleben von Zellen und ihre Einordnung in koordinierte Zellverbände – und somit essentiell für die Regeneration von beschädigtem Gewebe. Gele können ein Gerüst darstellen, müssen aber dafür die molekulare Umgebung, besonders deren physikalische Eigenschaften imitieren. Eigenschaften wie die Festigkeit der umgebenden Matrix können je nach Gewebe variieren. Das Team um Shastri hat Agarosegele durch Anheften von Carboxyl-Gruppen am Zuckergerüst so verändert, dass sie eher die physikalischen Eigenschaften einer natürlichen Zellumgebung erhalten. Hydrogele entstehen, wenn in einem Polymer die Molekülketten Querverbindungen ausbilden und Wasser einlagern. Die Hauptkomponente des Agarosegels ist eine Kette von Zuckermolekülen, die normalerweise eine schraubenartige Struktur ausbildet. Mit der Carboxylierung der Zuckerkette bildet sich aber eine Band-Struktur aus: Durch diesen Kniff lässt sich die Festigkeit des Gels an jedes Gewebe im Körper anpassen. Diese Entdeckung könnte helfen Verletzungen des Herz- und Muskelgewebes besser zu behandeln.
Mit Hilfe dieses Gels gelang es den Forscherinnen und Forschern einzelne Endothelzellen, die im Körper Blutgefäße ausbilden, so zu beeinflussen, dass sie auch im Labor Gefäßgewebe formten. Ausgelöst durch den richtigen Cocktail aus Signalmolekülen, der aus der Embryonalentwicklung bekannt ist, bildeten die Endothelzellen bis zu mehrere hundert Mikrometer breite, gefäßartige Strukturen aus. „Es ist erstaunlich, dass die Organisation der Endothelzellen in unseren Gelen ohne umgebende unterstützende Zellen stattfinden kann“, sagt Shastri. Lange dachte man, Gefäßstrukturen benötigten solche unterstützende Zellen, an denen entlang sich die Endothelzellen anheften und organisieren. Zudem scheint es, dass die Zellen sich umstrukturieren müssen, um die Entwicklung der Gefäße im Labor – wie auch im Embryo – zu ermöglichen. „Wir waren überrascht, dass die Endothelzellen diese so genannte apikal-basale Polarisation durchlaufen“, fügt Shastri hinzu. Dass im Gel diese Polarisation in einer dreidimensionalen Zellkultur eines synthetischen Polymers gelingt, ist einzigartig.
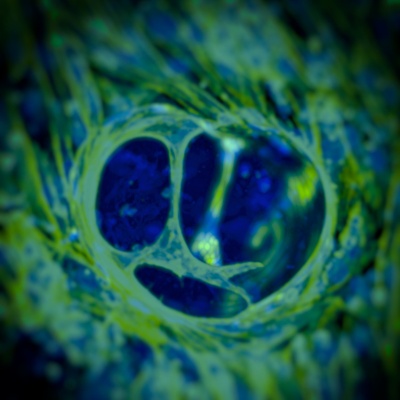
Menschliche Endothelzellen verzweigen und organisieren sich zu Gefässgewebe im carboxylierten Agarosegel
© Aurelien Forget, Prasad Shastri
Originalpublikation:
Aurelien Forget, Jon Christensen, Steffen Lüdeke, Esther Kohlera, Simon Tobias, Maziar Matloubi, Ralf Thomann, and V. Prasad Shastri Polysaccharide hydrogels with tunable stiffness and provasculogenic properties via α-helix to β-sheet switch in secondary structure. Proc. Natl. Acad. Sci. USA Vol.110, no 32 doi: 10.1073/pnas.1222880110
Kontakt:
Prof. Dr. V. Prasad Shastri
Institut für Makromolekulare Chemie
BIOSS Centre for Biological Signalling Studies
Tel.: 0761/203-6268
E-Mail: prasad.shastrI@makro.uni-freiburg.de
Die Druckversion der Pressemitteilung (pdf) finden Sie hier.

