„Krebszellen überhören oft Stoppsignale“
Freiburg, 14.03.2019
Auch Immunzellen brauchen Nahrung. Wie sie auf Mangel und Überfluss reagieren, untersucht Dr. Julia Jellusova im Exzellenzcluster CIBSS – Centre for Integrative Biological Signalling Studies. Der Stoffwechsel beeinflusst die Funktion der Zellen. Möglicherweise trägt er dazu bei, dass sie zu Krebszellen werden. Darüber und wie sich Lymphknotenkrebs vielleicht bremsen ließe, möchte Immunologin Jellusova mehr herausfinden.

Julia Jellusova hatte schon als Kind eine Leidenschaft für Biologie – mit dem „Metabolic Signalling“ arbeitet sie an einer noch jungen, doch vielversprechenden Forschungsrichtung. Foto: Harald Neumann
Um Krankheitserreger effektiv zu bekämpfen, braucht das Immunsystem Antikörper. Bis die optimal und fertig sind, muss allerdings Einiges passieren. Bestimmte Immunzellen, die B-Zellen, treffen auf die Erreger, teilen sich mehrfach, durchlaufen Umbau- und Ausleseprozesse und stellen am Ende Antikörper her. Das kostet eine Menge Energie. „Für diese Prozesse muss eine entsprechende Umgebung vorhanden sein“, betont Dr. Julia Jellusova von BIOSS und CIBSS, den Exzellenzclustern zur biologischen Signalforschung der Universität Freiburg. Ohne ausreichend Nährstoffe und Sauerstoff reifen B-Zellen nicht ordentlich heran. „Wie Immunzellen auf ihre Umgebung reagieren und ihren Stoffwechsel regulieren, ist ein recht neues Thema in der Immunologie“, sagt Jellusova. Denn die Beschaffenheit der Nährstofflage und Fehler im Stoffwechsel sind womöglich auch für die Entstehung von Krebs und Autoimmunerkrankungen bedeutend.
Die Teilung geht zu schnell
„Immunologinnen und Immunologen haben immer gedacht, B-Zellen holen sich einfach, was sie benötigen“, erzählt Jellusova. Weit gefehlt. B-Zellen reagieren anders als normal, wenn das Umfeld nicht passt – wenn Nährstoffe oder Sauerstoff fehlen, der Zellstoffwechsel nicht glatt läuft oder seine Regulatoren versagen. Ein derartiges Steuerprotein hat die 34-jährige Forscherin schon untersucht: die Stoffwechselbremse GSK3. Der Reifungsprozess von B-Zellen umfasst starke Teilungsphasen. Für diese Kraftanstrengung stellt sich ihr Stoffwechsel so um, dass die Zellen mehr Nährstoffe aufnehmen und verarbeiten können. Dann geht’s ruckzuck. Doch zu flott dürfen sich B-Zellen nicht vermehren, sonst geraten sie womöglich außer Kontrolle. „GSK3 sagt der Zelle: Du teilst dich zu schnell“, erklärt Jellusova. Daraufhin nehmen B-Zellen weniger Nährstoffe auf, schrauben ihren Stoffwechsel runter und beenden ihre Vermehrung.
|
Biologische Signale und Signalwege Damit Billionen von Zellen geordnete Gewebe, Organe und gesunde Organismen bilden, erhalten und regenerieren, ist eine sehr genaue Abstimmung nötig. Dazu laufen komplexe Kommunikationsprozesse zwischen und innerhalb von Zellen ab. Defekte in diesen Kommunikationsnetzwerken können Entwicklungsstörungen, Immunschwäche, Krebs und andere Erkrankungen auslösen. Der Cluster CIBSS verfolgt das Ziel, ein umfassendes Verständnis von diesen Kommunikationsprozessen zu gewinnen – von der molekularen Ebene bis hin zur Ebene von Zellen und Organen. Des Weiteren werden CIBSS-Forschungsgruppen untersuchen, wie diese Kommunikationsprozesse mit anderen wichtigen biologischen Prozessen, wie etwa dem Stoffwechsel, in Verbindung stehen. Basierend auf den neuen Erkenntnissen werden die Forschenden Perspektiven entwickeln, um Herausforderungen in der Immuntherapie oder der nachhaltigen Produktion von Nutzpflanzen zu begegnen.
|
„Ich habe GSK3 genetisch ausgeschaltet“, erklärt die Forscherin. Im Vergleich zu normalen B-Zellen teilen sich solche mit inaktivem GSK3 schneller, wenn genug Nährstoffe vorliegen. Dafür sterben sie aber viel früher, wenn sie Hungerstress leiden. „Die Zellen wissen nicht, wann sie aufhören sollen, sich zu teilen“, vermutet Jellusova. Irgendwann gehen ihnen dann Nährstoffe und Energie aus. Die Zellen verhungern. Die Immunologin möchte einige Fragen klären: Wie arbeitet GSK3 genau? Was müsste passieren, damit B-Zellen ohne GSK3 entarten – und zu Krebszellen werden? „Krebszellen überhören oft Stoppsignale wie GSK3“, erklärt Jellusova. Sie teilen sich dann ungebremst, wofür sie aber enorm viele Nährstoffe brauchen. Entsprechend robust müssen Krebszellen gegen Hungerstress sein. Manchmal hilft da ein anderes Protein. „Es sendet Überlebenssignale.“ Zudem ist das Protein häufig in Signalwegen entarteter B-Zellen aktiv: Vielleicht hilft es auch hungernden B-Zellen mit inaktivem GSK3 und verwandelt sie in Tumorzellen?
Neben der Forschung entstehen Kinderbücher
Jellusovas Spezialgebiet, das „Metabolic Signalling“, ist eine wichtige neue Forschungsrichtung in CIBSS. Das Thema Immunzellen und Nährstoffe fesselt die Nachwuchsforscherin seit der Diplomarbeit, die Biologie bereits seit ihrer Kindheit. „Ich habe schon mit fünf Jahren Pflanzen getrocknet und ein Herbarium angelegt“, erzählt sie. Zum sechsten Geburtstag schenkte ihr Vater ihr ein Mikroskop: „Das war mein größter Schatz.“ Später studierte sie Biologie in Erlangen, wo sie 2010 in Immunologie promovierte. Nach einem Abstecher als Postdoc ins kalifornische La Jolla kam sie 2016 in den Breisgau. „Freiburg ist auf dem Gebiet Stoffwechsel und Immunsystem einzigartig. Eine Expertise wie hier gibt es fast nirgendwo anders.“ Unterstützt vom Margarete von Wrangell-Habilitationsprogramm für Frauen leitet Jellusova im Signalhaus BIOSS eine dreiköpfige Arbeitsgruppe. Daneben schreibt sie Kinderbücher, zuletzt das Sachbuch „Entdecke dein Immunsystem“.
Jellusova will ein Protein wissenschaftlich unter die Lupe nehmen: p62, das auch Sequestosom 1 heißt. „Es ist ein Adaptor-Protein, das die Signalleitung in B-Zellen reguliert, indem es verschiedene Moleküle zusammenbringt.“ Stehen nicht genug Nährstoffe zur Verfügung, können B-Zellen alte Mitochondrien und andere eigene Zellteile verdauen. Indem sie ausgediente Zellbestandteile verwerten, können B-Zellen ihren Energiebedarf vorübergehend stillen. „Dabei spielt p62 eine Rolle. Aber niemand weiß, was passiert, wenn p62 nicht funktioniert.“ Jellusova wird das Protein zuerst in normalen B-Zellen abschalten, später in hungernden. Was macht p62 hier jeweils genau? Dann will sie mit Peptiden und anderen Molekülen einzelne Schritte in den Signalwegen, an denen p62 in B-Zellen teilnimmt, hemmen, stimulieren und erhellen. Nicht zuletzt interessiert die Immunologin, ob auch p62 dazu beitragen kann, wenn B-Zellen entarten: „In anderen Zelltypen ist das mal so, mal so – es fördert oder hemmt die Entstehung von Krebszellen.“
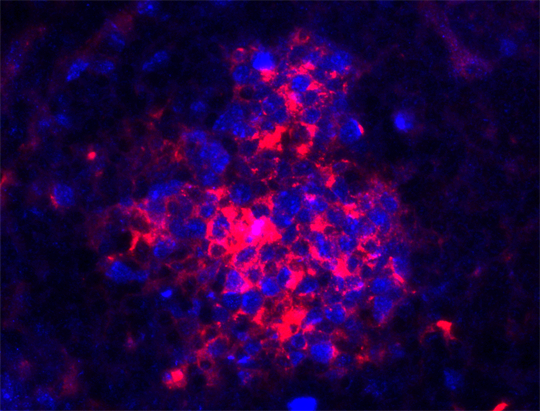
Lymphknotenkrebs entwickelt sich zu großen Teilen aus B-Zellen (rot). Quelle: Julia Jellusova
Trägt der Stoffwechsel zu Autoimmunkrankheiten bei?
Was ist eigentlich B-Zell-Krebs? „Lymphknotenkrebs entwickelt sich zum großen Teil aus B-Zellen“, erklärt Jellusova. Diese Zellen entarten recht oft, eben weil in ihrem Reifungsprozess mehrere rapide Vermehrungsphasen vorkommen und sie zudem noch mutieren. Durch Mutation entstehen nach der ersten Begegnung mit einem neuen Erreger viele unterschiedliche B-Zellen. Jede trägt auf ihrer Außenhülle einen anderen Rezeptor, der diesen Erreger erkennen sollte. „Doch es gibt gute und schlechte Rezeptoren. Die B-Zellen mit den schlechten Rezeptoren müssen sterben.“ Nach harter Auswahl bleibt die beste B-Zelle übrig. Sie vermehrt sich. Ihre Nachkommen bilden die Antikörper, mit deren Hilfe das Immunsystem am Ende den Erreger abwehrt – im Normalfall.
Aber wie reagieren B-Zellen auf metabolischen Stress, und wie beeinflusst er ihre Funktion? Solche grundlegenden Dinge treiben Julia Jellusova derzeit am meisten um. Ein paar sind bereits bekannt. So verfügen B-Zellen außen etwa über Rezeptoren für manche Nährstoffe wie Glukose und Aminosäuren. „Sie haben auch Rezeptoren in der Zelle, die messen, wie viel von denen da ist.“ Darüber hinaus gibt es noch viele Wissenslücken: Welche Rolle spielt der Stoffwechsel, wenn sich Krebs aus B-Zellen entwickelt oder Autoimmunkrankheiten wie Lupus erythematodes und rheumatoide Arthritis entstehen? Auch da mischen B-Zellen teils maßgeblich mit. Im Moment konzentriert sich Jellusova hauptsächlich auf Grundlagenforschung und das p62 Protein. „Aber ich hoffe, dass sich daraus auch irgendwann einmal Ansätze ergeben, mit denen sich Formen von Krebs und manche Autoimmunerkrankungen aufhalten lassen.“
Jürgen Schickinger
CIBSS – Centre for Integrative Biological Signalling Studies
CIBSS ist einer der beiden neuen Exzellenzcluster der Universität Freiburg. Darin werden mehr als 60 Arbeitsgruppen biologische Signalprozesse von Immunzellen, rund um Mitochondrien, in der Organentwicklung und in Wurzeln von Pflanzen erforschen. Die Wissenschaftlerinnen und Wissenschaftler kommen aus sechs Fakultäten – der Fakultät für Biologie, Mathematik und Physik, Medizin, Chemie und Pharmazie, Technik sowie der Fakultät für Rechtswissenschaften. Auch das Universitätsklinikum sowie das Max-Planck-Institut für Immunbiologie und Epigenetik sind beteiligt. Die Deutsche Forschungsgemeinschaft fördert den Cluster von Anfang 2019 bis Ende 2025.
CIBSS – Centre for Integrative Biological Signalling Studies